これまでの主な研究内容
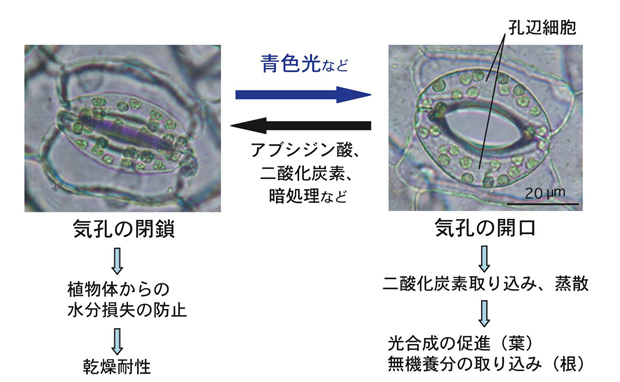
陸生植物の表皮に存在する気孔は、一対の孔辺細胞に囲まれた孔で、変転する環境に応じて開閉し、光合成に必要な二酸化炭素の取り込みや蒸散など植物と大気間のガス交換を調節している。孔辺細胞は、光合成が盛んに行われる光照射下、特にシグナルとして作用する青色光に反応して気孔を開き、ガス交換を促進し、乾燥ストレスに曝されると植物ホルモン・アブシジン酸に応答して気孔を閉じ、植物体からの水分損失を防ぐ。気孔の開閉は、孔辺細胞が外部からのシグナルに的確に応答してシグナル伝達を行い、各種イオンの流入・流出に関わるポンプやチャネル活性を調節し、最終的に孔辺細胞の体積が変動することにより引き起こされる高次の生命現象である(下図)。
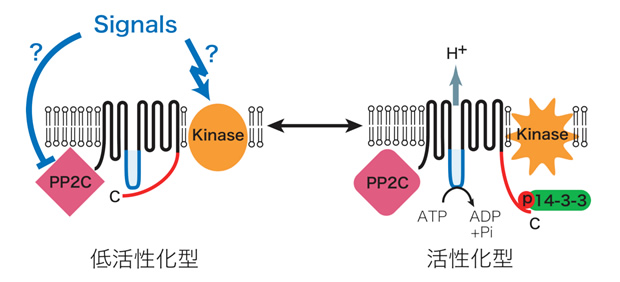
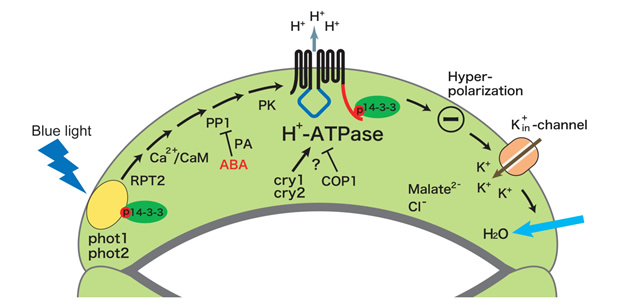
青色光は、孔辺細胞のATP要求性細胞膜H+ポンプを活性化し、細胞膜の過分極を引き起こす。これに応答して電位依存性K+チャネルが孔辺細胞内へ大量のK+を流入させ、それに伴い水が取り込まれ気孔開口に至る(1)。しかしながら、青色光受容体やH+ポンプの実体など、シグナル伝達の分子レベルでの解明はほとんど進んでいなかった。そこで、まず、青色光に活性化されるH+ポンプについて、ソラマメ孔辺細胞プロトプラストにおけるATPase活性測定法を確立して解析を行い、その実体が植物特有のP型ATPaseの細胞膜H+-ATPaseであることを明らかにした。また、in vivo [32P]ラベルした孔辺細胞を用いた解析により、青色光はH+-ATPaseのC末端領域のリン酸化を引き起こし、リン酸化されたC末端に14-3-3 蛋白質が結合すること見出した(2)。さらに、活性化の分子機構について解析を進め、定常状態で自己阻害的に働いているC末端領域のThr950が青色光によりリン酸化され、そこに14-3-3蛋白質が結合することによってH+-ATPaseが活性化されることを証明した(3)。細胞膜H+-ATPaseは、気孔の開口だけでなく、植物細胞おける二次輸送体を介した物質輸送や膜電位・細胞内外pHの調節など極めて重要な役割を果たしているが、細胞内での活性調節機構は不明であった。本成果は、生理的シグナルによる細胞膜H+-ATPaseの活性化機構を示した初めての例となった(4)(下図)。
この研究過程において、ソラマメ孔辺細胞において青色光により自己リン酸化する125 kDa蛋白質を発見し、その蛋白質が芽生えの光屈性の青色光受容体として同定されていたフォトトロピンであることを突き止めた(5)。そこで、モデル植物シロイヌナズナのフォトトロピン変異体(phot1, phot2)における気孔の青色光反応を調べ、phot1とphot2の各シングル変異体では正常だが、2重変異体においては気孔の青色光反応が全く見られないことを示し、phot1とphot2が重複して細胞膜H+-ATPase活性化・気孔開口の青色光受容体として機能していることを証明した(6, 7)(下図)。
フォトトロピンは、Ser/Thrキナーゼドメインを持つ光受容体であり、気孔開口のみならず、光屈性、葉緑体光定位運動や葉の横伸展の光受容体として機能する。そこで、フォトトロピンにより引き起こされる諸反応の生理的役割について解析を行い、フォトトロピンは、弱い光環境のもとで上記の諸反応を引き起こして光合成能を増大させ、結果的に植物の生長を促進していることを実証した(8)。
以上の研究と並行して、ペンシルバニア州立大学のAssmann教授らとの共同研究により、アブシジン酸による気孔閉鎖に関与するプロテインキナーゼ AAPKの細胞内基質の探索を行い、アブシジン酸に応答してAAPKがヘテロ核RNA結合蛋白質A/B(AKIP1)をリン酸化することを示した(9)。さらに、孔辺細胞の細胞膜H+-ATPaseが生理的濃度のCa2+により可逆的に阻害されることを見出し、アブシジン酸による孔辺細胞細胞質のCa2+濃度上昇に伴い細胞膜H+-ATPaseが阻害され、気孔閉鎖が促進されている可能性を示した(10)。
また、2003年10月から1年間滞在したSalk生物学研究所のJ. Chory教授の研究室では、植物の正常な成長や分化において重要な役割を果たす植物ホルモン・ブラシノステロイド(BR)の受容機構について研究を行い、受容体型キナーゼBRI1がBR受容体であることを証明した(11)。
今後の研究目的
これまでの研究の主な成果として、気孔開口に関わる青色光受容体(フォトトロピン)や効果器(細胞膜H+-ATPase)の実体を明らかにしたが、フォトトロピンからH+-ATPase活性化に至るシグナル伝達やH+-ATPaseのリン酸化反応を触媒する酵素は未解明である。現在は、気孔の開閉シグナル伝達機構やH+-ATPaseの活性調節の分子機構の全容解明を目指し、生理・生化学・分子遺伝学的手法を駆使して、以下のような研究進めている。
気孔開閉の分子機構についての生理・生化学的解析
モデル植物シロイヌナズナやソラマメから単離した高純度孔辺細胞プロトプラストを用い、細胞膜H+-ATPase複合体解析や青色光やアブシジン酸に応答した蛋白質リン酸化反応の解析、孔辺細胞特異的に発現する遺伝子の機能解析を進めている。
分子遺伝学的手法による気孔開度変異体の単離
植物の気孔開度測定は大変時間を要するため、ハイスループットな選抜が可能な様々な方法によりスクリーニングを行い、シロイヌナズナにおける新奇の気孔開度変異体の単離と原因遺伝子の機能解析を進めている。
細胞膜H+-ATPaseの活性調節機構と突然変異体の単離
気孔孔辺細胞を用いた研究により明らかとなったC末端のリン酸化と14-3-3蛋白質の結合によるH+-ATPaseの活性化機構は、孔辺細胞以外の細胞でも見られる生理的な活性化機構であることが証明されつつある。しかしながら、C末端リン酸化に関わるプロテインキナーゼやホスファターゼの実体は明らかとなっていない。そこで、生化学的手法によるC末端のリン酸化の解析(12)、さらに、シロイヌナズナを用いた様々なスクリーニングにより、新奇の細胞膜H+-ATPaseの活性調節変異体の単離を進めている。
参考文献
- Shimazaki K, Doi M. Assmann SM, Kinoshita T. (2007) Light regulation of stomatal movement. Annu. Rev. Plant Biol. 58:219-247.
- Kinoshita T, Shimazaki K. (1999) Blue light activates the plasma membrane H+-ATPase by phosphorylation of the C-terminus in stomatal guard cells. EMBO J. 18: 5548-5558.
- Kinoshita T, Shimazaki K. (2002) Biochemical evidence for the requirement of 14-3-3 protein binding in activation of the guard-cell plasma membrane H+-ATPase by blue light. Plant Cell Physiol. 43:1359-1365.
- 木下俊則、島崎研一郎「気孔の開口を駆動する細胞膜H+-ATPase」蛋白質核酸酵素 51, 871-876. (2006年)
- Kinoshita T, Emi T, Tomonaga M, Sakamoto K, Shigenaga A, Doi M, Shimazaki K. (2003) Blue light- and phosphorylation-dependent binding of a 14-3-3 protein to phototropins in stomtal guard cells of broad bean. Plant Physiol. 133: 1453-1463
- Kinoshita T, Doi M, Suetsugu N, Kagawa T, Wada M, Shimazaki K. (2001) phot1 and phot2 mediate blue light regulation of stomatal opening. Nature 414: 656-660.
- Inoue S, Kinoshita T, Matsumoto M, Nakayama K, Doi M, Shimazaki K. (2008) Blue light-induced autophoshporylation of phototropin is a primary step for signaling. Proc. Natl. Acad. Sci. USA 105, 5626-5631.
- Takemiya A, Inoue S, Doi M, Kinoshita T, Shimazaki K. (2005) Phototropins promote plant growth in response to blue light in low light environments. Plant Cell 17: 1120-1127.
- Li J, Kinoshita T, Pandey S, Ng CKY, Gygi ST, Shimazaki K, Assmann AM. (2002) Modulation of an RNA-binding protein by abscisic-acid-activated protein kinase. Nature 418: 793-797.
- Kinoshita T, Nishimura M, Shimazaki K. (1995) Cytosolic concentration of Ca2+ regulates the plasma membrane H+-ATPase in guard cells of Fava bean. Plant Cell 7: 1333-1342.
- Kinoshita T, Cano-Delgado A, Seto H, Hiranuma S, Fujioka S, Yoshida S, Chory J. (2005) Binding of brassinosteroids to the extracellular domain of plant receptor kinase BRI1. Nature 433: 167-171.
- Hayashi, Nakamura S, Takemiya A, Takahashi Y, Shimazaki K, Kinoshita T. (2010) Biochemical characterization of in vitro phosphorylation and dephosphorylation of the plasma membrane H+-ATPase. Plant Cell Physiol. 51, 1186-1196.
研究内容(高橋洋平)
陸上植物が環境ストレスに応答し、耐性を獲得する基本的な分子メカニズムを解明することは、基礎生物学としての重要性に加え、将来的な植物のストレス耐性増進、植物の特性を活用した環境改善などの視点からも重要です。乾燥や、大気中の CO2濃度の急激かつ継続的な上昇に対する植物の反応など、我々が解明しようとしている細胞機能と分子メカニズムは、陸上植物の効率的な水利用に直接関係しています。非生物的ストレスは、世界各地で植物の成長とバイオマス生産を減少させ、気候変動や人口増加に付随する食料・エネルギー問題にも関連しています。
私たちは、植物のCO2濃度感知や、ストレスホルモンであるアブシジン酸のシグナル伝達カスケードなどに着目し、生化学・分子遺伝学・細胞生物学的・ケミカルバイオロジーなど多彩なアプローチを駆使し、植物が質的・量的・時間的に多様な非生物的ストレスに対してどのように環境に適応しているのか、主に気孔の開閉に着目して、その基盤となる分子メカニズム解明を目指しています。
植物の気孔は、光に応答して開口する一方で、乾燥やCO2濃度上昇に応答して閉鎖します。このことは、動くことができない植物が、体内の水をできるだけ効率よく使用・保存して厳しい環境を生き抜くために必要不可欠な生理応答だと考えられます。我々は、モデル植物シロイヌナズナを用いた国際的な共同研究によって、乾燥によって生合成されるアブシジン酸の、初期情報伝達コア機構を構成する新因子を見出しました (Takahashi et al., Nature Commun, 2020)。さらに最近では、植物の気孔においてCO2濃度を感知するCO2/bicarbonate センサー分子を同定しました(Takahashi et al., Sci Adv, 2022)。2種類のタンパク質からなるこの植物独自のセンサーモジュールは、CO2/bicarbonate に依存して互いに結合することにより、気孔開口を抑制します(下図)。この反応は植物の効率的な水利用とCO2獲得の鍵になっていると思われます。このような重要因子の発見と、情報伝達カスケードのメカ
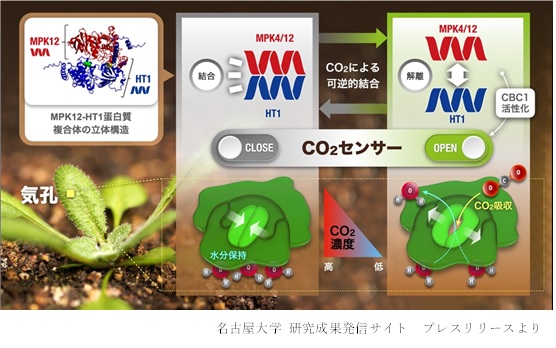
ニズム解明は、新たなシグナル伝達の概念を生み出し、植物細胞が備える非常に精緻な情報処理能力を浮き彫りにします。
植物の気孔は、光や乾燥、CO2、湿度、植物ホルモンなど実に多様な刺激を感知して、環境に応じて最適なCO2取り込みと水利用を達成するために、環境刺激を細胞自体の膨圧変化に変換し、これによって気孔の開度を制御して、植物と大気間のガス交換をダイナミックに調節しています。気孔を構成する孔辺細胞は、どのようにしてこれらの複雑かつ正確な刺激の感知・変換・統合装置とそれらのクロストークを構築したのでしょうか。これを追求することは、細胞機能の原理を理解するという大きなゴールに近づいていくことだと考えています。
私たちは、個々の研究プロジェクトの主体的な追求を通して知識や実験技法を習得し、プレゼンや執筆などの基礎的な訓練もおこないつつ、ITbMの特徴を活かした新たな分野にもオープンに挑戦していきたいと考えています。
参考文献(高橋洋平)
- Y. Takahashi, Y. Ebisu, T. Kinoshita, M. Doi, E. Okuma, Y. Murata, K. Shimazaki, bHLH transcription factors that facilitate K+ uptake during stomatal opening are repressed by abscisic acid through phosphorylation. Sci Signal 6, ra48 (2013).
- Y. Takahashi, T. Kinoshita, M. Matsumoto, K. Shimazaki, Inhibition of the Arabidopsis bHLH transcription factor by monomerization through abscisic acid-induced phosphorylation. Plant J 87, 559-567 (2016).
- Y. Takahashi, Y. Ebisu, K. I. Shimazaki, Reconstitution of Abscisic Acid Signaling from the Receptor to DNA via bHLH Transcription Factors. Plant Physiol 174, 815-822 (2017).
- J. Zhang, P. De-Oliveira-Ceciliato, Y. Takahashi, S. Schulze, G. Dubeaux, F. Hauser, T. Azoulay-Shemer, K. Tõldsepp, H. Kollist, W. J. Rappel, J. I. Schroeder, Insights into the Molecular Mechanisms of CO2-Mediated Regulation of Stomatal Movements. Curr Biol 28, R1356-R1363 (2018).
- P. K. Hsu, Y. Takahashi, S. Munemasa, E. Merilo, K. Laanemets, R. Waadt, D. Pater, H. Kollist, J. I. Schroeder, Abscisic acid-independent stomatal CO2 signal transduction pathway and convergence of CO2 and ABA signaling downstream of OST1 kinase. Proc Natl Acad Sci U S A 115, E9971-E9980 (2018).
- K. Tõldsepp1, J. Zhang1, Y. Takahashi1, Y. Sindarovska, H. Hõrak, P. H. O. Ceciliato, K. Koolmeister, Y. S. Wang, L. Vaahtera, L. Jakobson, C. Y. Yeh, J. Park, M. Brosche, H. Kollist, J. I. Schroeder (1Co-first authors), Mitogen-activated protein kinases MPK4 and MPK12 are key components mediating CO2-induced stomatal movements. Plant J 96, 1018-1035 (2018)
- P. K. Hsu, G. Dubeaux, Y. Takahashi, J. I. Schroeder, Signaling mechanisms in abscisic acid-mediated stomatal closure. Plant J, (2020).
- Y. Takahashi, J. Zhang, P. K. Hsu, P. H. O. Ceciliato, L. Zhang, G. Dubeaux, S. Munemasa, C. Ge, Y. Zhao, F. Hauser, J. I. Schroeder, MAP3Kinase-dependent SnRK2-kinase activation is required for abscisic acid signal transduction and rapid osmotic stress response. Nat Commun 11, 12 (2020).
- L. Zhang1, Y. Takahashi1*, P. K. Hsu, H. Kollist, E. Merilo, P. J. Krysan, J. I. Schroeder*, (1Co-first authors, *Co-corresponding authors) FRET kinase sensor development reveals SnRK2/OST1 activation by ABA but not by MeJA and high CO2 during stomatal closure. Elife 9, (2020).
- Y. Hayashi, Y. Takahashi*, K. Fukatsu, Y. Tada, K. Takahashi, K. Kuwata, T. Suzuki, T. Kinoshita* (*Co-corresponding authors), Identification of Abscisic Acid-Dependent Phosphorylated Basic Helix-Loop-Helix Transcription Factors in Guard Cells of Vicia faba by Mass Spectrometry. Front Plant Sci 12, 735271 (2021).
- P. K. Hsu, Y. Takahashi, E. Merilo, A. Costa, L. Zhang, K. Kernig, K. H. Lee, J. I. Schroeder, Raf-like kinases and receptor-like (pseudo)kinase GHR1 are required for stomatal vapor pressure difference response. Proc Natl Acad Sci U S A 118, (2021).
- Y. Takahashi*, K. C. Bosmans, P. K. Hsu, K. Paul, C. Seitz, C. Y. Yeh, Y. S. Wang, D. Yarmolinsky, M. Sierla, T. Vahisalu, J. A. McCammon, J. Kangasjarvi, L. Zhang, H. Kollist, T. Trac, J. I. Schroeder* (*Co-corresponding authors), Stomatal CO2/bicarbonate sensor consists of two interacting protein kinases, Raf-like HT1 and non-kinase-activity requiring MPK12/MPK4. Sci Adv 8, eabq6161 (2022).
- R. Waadt, C. A. Seller, P.-K. Hsu, Y. Takahashi, S. Munemasa, J. I. Schroeder, Plant hormone regulation of abiotic stress responses. Nature Reviews Molecular Cell Biology, (2022).